Un coeur, recto-verso et en couleur
Au croisement de la biologie, de l’ingénierie et de l’informatique, la bio impression 3D incarne la perspective d’une révolution médicale : réinventer le don d’organes. Les receveurs restent aujourd’hui plus nombreux que les donneurs. Et face à la pénurie d’organes, la science explore à grande vitesse une solution d’avenir : imprimer des organes directement à partir des cellules des patients.

Une perspective qui tient autant du progrès médical que de la science-fiction. Celle de créer des organes sur mesure pour chacun des 22 585 patients inscrits sur la liste d’attente nationale de greffe au 1er janvier 2025, selon l’Agence de la biomédecine. En d’autres termes, faire du receveur son propre donneur. Comment cela fonctionne-t-il exactement ? Et où en est-on aujourd’hui ? Si la date de la révolution du don d’organe n’est pas actée, la course au premier organe vivant imprimé, elle, est lancée.
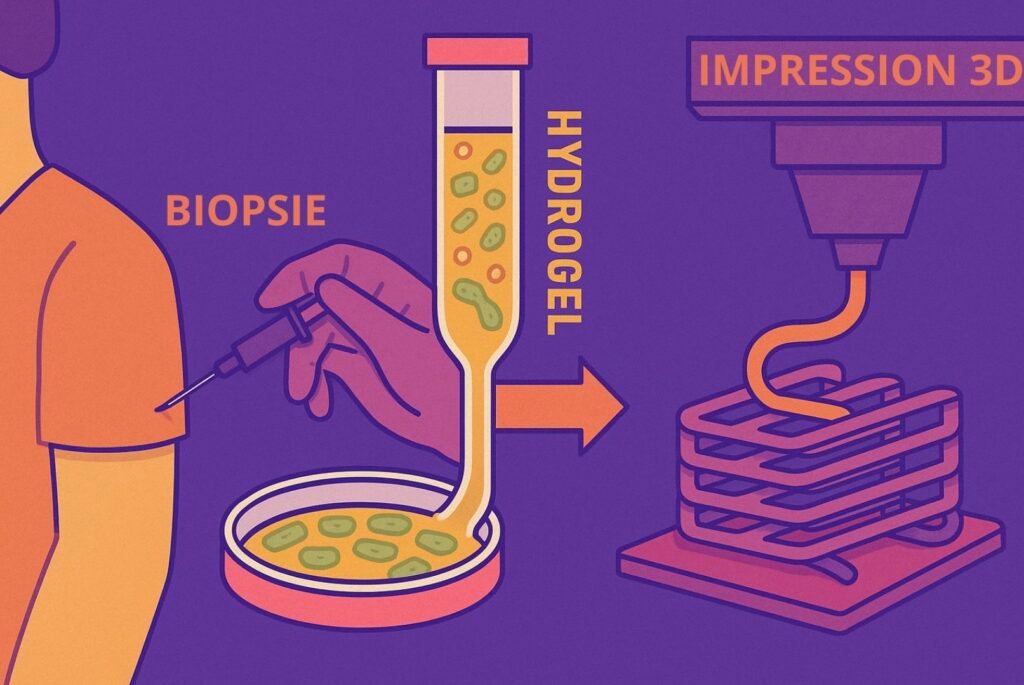
La bio-impression 3D repose sur le même principe que l’impression 3D classique : créer des objets par superposition de couches successives. À la différence près qu’on remplace ici le plastique par une bio-encre, obtenue à la suite d’une série d’étapes clés.
Tout commence par une biopsie. Les médecins prélèvent une petite quantité de cellules saines sur le patient, ensuite cultivées en laboratoire jusqu’à en obtenir une quantité suffisante. Il est alors temps de créer l’encre biologique : on mélange les cellules à un hydrogel, une substance gélatineuse riche en eau et en biomatériaux comme le collagène, qui mime l’environnement naturel des tissus humains. L’imprimante 3D spécialement conçue pour manipuler des tissus vivants dépose enfin les cellules couche par couche, structurant le futur organe. C’est en tout cas l’objectif pour les années à venir.
Acquis et progrès
Peau, cornée, cartilage, vaisseaux sanguins… La bio-impression permet aujourd’hui de reproduire des tissus simples. Des structures utiles pour tester des médicaments ou réparer certaines lésions superficielles. Mais les organes plus complexes (cœur, rein, foie) posent encore de nombreux défis. Imprimer un organe viable, c’est aussi imprimer tout son système vasculaire parfaitement fonctionnel (réseau de vaisseaux sanguins capable d’apporter de l’oxygène et des nutriments). Et un tel exploit n’est pas prévu pour tout de suite.
Chloé Devillard, docteur en biotechnologie, présentait en 2023 le projet Genesis, dont elle est à l’initiative. « Un projet de médecine régénérative ayant pour ambition de réparer l’Homme de demain grâce à la biofabrication d’organes sur-mesure, via la technologie de bio-impression 3D », décrivait-elle dans une publication LinkedIn. Sa « première mission » : imprimer le premier modèle de « cœur humain vivant ». Un pari qui n’avait pas encore atteint à l’époque le stade d’étude préclinique sur animaux. Si la spécialiste espérait pouvoir observer des résultats rapides d’abord sur l’impression de « tissu cardiaque régénératif » (dans les cinq ans), par exemple pour réparer un cœur abimé, elle évoquait plutôt des « dizaines d’années » avant la création du tout premier cœur vivant imprimé.
Mais les chercheurs progressent. Récemment, Guohao Dai, chercheur à l’université Northeastern de Boston, et Yi Hong, de l’Université du Texas à Arlington, ont développé un nouvel hydrogel plus résistant, plus souple, capable de supporter l’impression de tissus complexes tout en favorisant la prolifération cellulaire. L’objectif étant que le matériau disparaisse complètement au fur et à mesure que les cellules le remplacent par leur propre collagène et élastine, formant ainsi un vaisseau sanguin naturel et solide.
Médecine régénérative ou d’amélioration ?
À terme, la promesse de la bio-impression devrait permettre d’éviter les longues listes d’attente, de limiter les risques de rejet et de s’affranchir de la rareté des donneurs. Mais cette technologie soulève aussi des questions : qui pourra en bénéficier ? Et à quel prix ?

Entre la bio-imprimante spécialisée, les biomatériaux et les équipes pluridisciplinaires (biologistes, ingénieurs, médecins, etc.) mobilisées, le coût d’un organe imprimé à ce jour dépasse largement la centaine de milliers d’euros – et il ne s’agit que de prototypes non implantables. Même en anticipant une baisse des coûts à long terme, cette technologie restera onéreuse pendant plusieurs années, en particulier dans les pays à systèmes de santé déjà inégalitaires.
En France, l’accès à la greffe repose sur des critères médicaux, et les coûts sont pris en charge par la Sécurité sociale. Mais rien ne garantit que ce modèle s’appliquera tel quel à la bio-impression, notamment si les organes imprimés sont produits par des entreprises privées. Le risque serait alors de se heurter à l’apparition d’une « médecine à deux vitesses », où certains peuvent s’offrir un cœur imprimé sur mesure quand d’autres attendent un donneur pendant des mois, des années, parfois en vain. Dans son bilan d’activité annuel, l’Agence de la biomédecine recensait 852 patients décédés en 2024 faute d’accès à une greffe.
La bio-impression ouvre aussi la voie à des perspectives plus controversées. Modification génétique combinée à l’impression, voire création d’organes hybrides, mêlant humain et synthétique… Un scénario encore lointain, mais qui pousse déjà certains bioéthiciens à demander un cadre juridique clair pour la médecine régénérative de demain.
Méïssa Guèye

